欧盟医疗器械法规 (EU MDR)非常关注临床安全和风险管理。 MDR第10条“对制造商的一般义务”要求制造商确保遵守其质量管理体系,并建立、实施、记录和维护附件I第3节所述的风险管理体系。
EU MDR对风险管理的要求
附件一(一般安全和性能要求)第一章(一般要求)第1至5节明确规定了风险管理的要求。这些包括:
确保设备在正常使用期间适合其预期用途
当与对患者的益处进行权衡时,可能与设备使用相关的风险构成可接受的风险。
尽可能降低风险。尽可能降低风险的要求意味着在不对收益风险比产生不利影响的情况下降低风险。
建立、实施、记录和维护风险管理系统,包括:
风险管理计划
识别和分析已知和可预见的危害
估计和评估正常使用和可预见的误用过程中的风险
消除或控制风险
评估生产阶段和上市后监测系统的信息对危害、发生频率、相关风险估计以及总体风险、收益风险比和风险可接受性的影响。必要时修改风险控制措施。
采取风险控制措施,优先采取:
安全设计和制造
充分的保护措施
安全信息
消除或降低与使用错误相关的风险
在与评估的患者和/或用户益处进行权衡时,将所有已知和可预见的风险和不良风险降至可接受的水平
为患者安全而设计
确保风险控制措施符合安全原则,同时考虑到一般技术水平。
降低和管理风险,以便判断与每种危害相关的残余风险以及总体残余风险是可以接受的。
确保在设计和制造过程中根据附件 I 第 II 章 — 一般性能和安全要求评估风险
欧盟MDR法规中有关风险管理的关键要素包括:
正常使用条件和可预见的误用
可用性和使用错误
尽可能降低风险
风险可接受性
每种危害的残余风险
总体残余风险
收益-风险分析
上市后活动
欧盟 MDR 2017/745 法规及其与 ISO 14971 的关系
该法规附件 I 第 l 章中的风险管理要求反映了 ISO 14971 中详述的要求。尽管该法规没有具体提及医疗器械风险管理标准ISO 14971,但它确实要求遵守协调标准。欧盟官方公报列出了适用于医疗器械的协调标准标包括了EN/ISO 14971,还包括其他与风险管理相关标准,如 EN/IEC 62366、EN/ISO 10993、EN/IEC 60601 和 EN/IEC 62304。
减少、消除、最小化、规避风险?
在MDR法规中,关于风险管理的一个比较令人困惑的问题是关于降低风险的不同要求。我们把分布在MDR法规中提及的243个“RISK”.进行分类汇总,形成下面这个非常实用的表格,大家可以根据表格确定减少、消除、最小化、规避风险这些词语分别在哪些条件下适用。
在 ISO 14971:2019 第 4.2 条中,注 1 指出,“制造商建立风险可接受性标准的政策可以定义风险控制的方法:将风险降低到合理可行的最低水平,将风险降低到合理可实现的低水平,或在不对收益风险比产生不利影响的情况下尽可能降低风险。
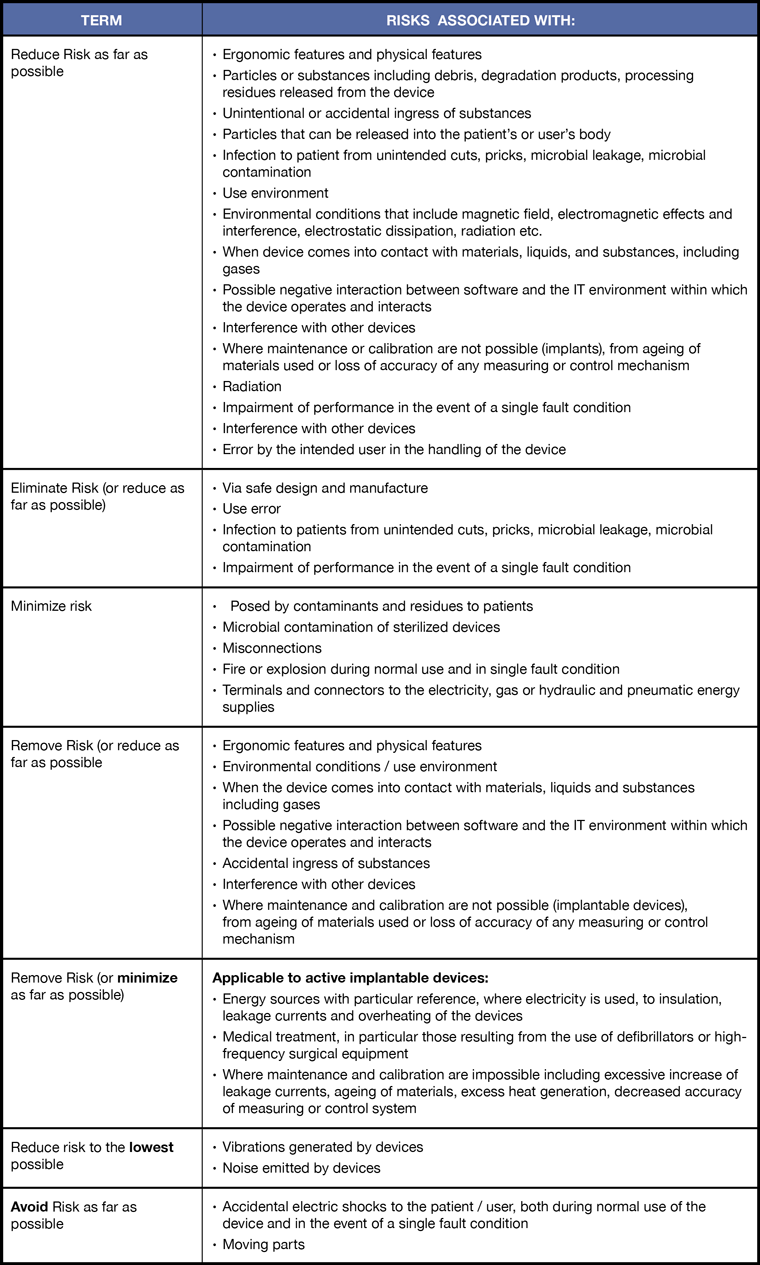
因此,由制造商根据上面和表中列出的所有不同要求确定他们将要管理风险的过程。制造商应明确制定形成文件的程序文件(风险控制程序),描述其降低风险的方法以符合法规中列出的所有不同要求。





